Trong hóa học, sự hiểu biết về ion hydronium (H3O+) là rất quan trọng. Đây là một loại ion rất quan trọng và có nhiều ứng dụng trong các lĩnh vực khoa học, y học và công nghiệp. Bài viết này trim-ion.com.vn sẽ trình bày chi tiết về sự hình thành ion hydronium (H3O+) từ H2O và H+, cũng như các tính chất và ứng dụng của nó.
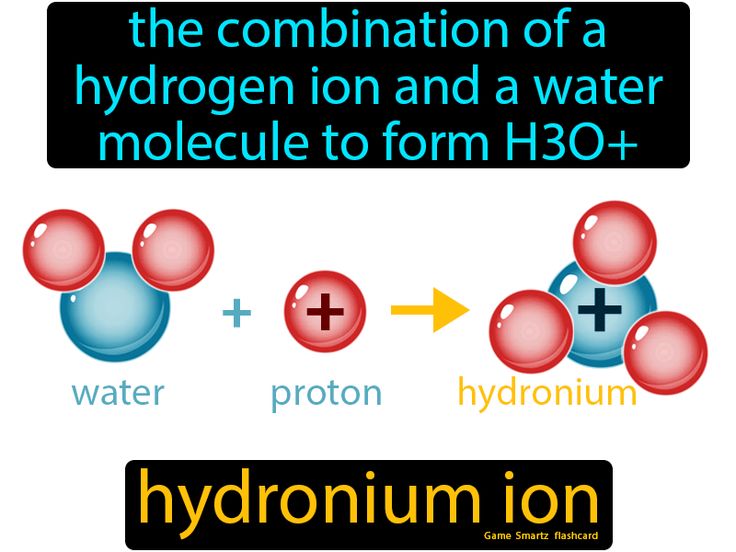
Khái niệm về ion hydronium H3O+
Ion hydronium (H3O+) là một loại ion gồm một nguyên tử oxy (O) và ba nguyên tử hydro (H) được kết nối lại với nhau. Nó được hình thành khi một proton (H+) tương tác với một phân tử nước (H2O) trong môi trường dung dịch.
Cấu trúc của ion hydronium H3O+
Ion hydronium có cấu trúc theo hình tứ diện, với nguyên tử oxy ở giữa và ba nguyên tử hydro ở ba góc của tứ diện. Các liên kết giữa oxy và hydro là liên kết cộng hóa trị, tạo thành một ion với tổng điện tích dương +1.
Sự hình thành ion hydronium H3O+
Ion hydronium H3O+ được hình thành khi một proton (H+) tương tác với một phân tử nước (H2O) trong dung dịch. Quá trình này có thể được miêu tả bằng phương trình hóa học sau:
H2O + H+ → H3O+
Trong phương trình này, proton H+ sẽ kết hợp với phân tử nước H2O, tạo thành ion hydronium H3O+.
Quá trình hình thành ion hydronium H3O+ từ H2O và H+
Quá trình hình thành ion hydronium H3O+ từ H2O và H+ bao gồm các bước sau:
Bước 1: Sự hiện diện của proton H+
Trong dung dịch, proton H+ có thể được tạo ra từ quá trình phân li của các axit, hoặc từ các phản ứng hóa học khác.
Bước 2: Tương tác giữa proton H+ và phân tử nước H2O
Khi có sự hiện diện của proton H+, nó sẽ tương tác với phân tử nước H2O, hình thành trung gian phản ứng.
Bước 3: Sự tạo thành ion hydronium H3O+
Quá trình tương tác giữa proton H+ và phân tử nước H2O sẽ dẫn đến sự hình thành ion hydronium H3O+.
Tính chất của ion hydronium H3O+
Ion hydronium H3O+ có các tính chất sau:
Tính axit
Ion hydronium H3O+ là một chất axit, có khả năng đưa proton H+ vào các phân tử khác, làm tăng nồng độ H+ trong dung dịch.
Tính lưỡng cực
Ion hydronium H3O+ có một cực tính lưỡng cực, với phần đuôi mang điện tích dương và phần đầu mang điện tích âm.
Tính bền vững
Ion hydronium H3O+ tương đối bền vững trong dung dịch, không dễ bị phân hủy hoặc tham gia các phản ứng hóa học khác.
Ảnh hưởng đến pH
Sự hiện diện của ion hydronium H3O+ trong dung dịch sẽ làm giảm pH của dung dịch, tạo ra môi trường axit.
Ảnh hưởng của nhiệt độ đến sự hình thành ion hydronium H3O+
Nhiệt độ là một yếu tố ảnh hưởng đến sự hình thành ion hydronium H3O+ trong dung dịch. Cụ thể:
Tăng nhiệt độ
Khi nhiệt độ tăng, quá trình phân li nước sẽ diễn ra mạnh hơn, dẫn đến sự gia tăng nồng độ proton H+ trong dung dịch. Điều này sẽ thúc đẩy quá trình hình thành ion hydronium H3O+.
Giảm nhiệt độ
Khi nhiệt độ giảm, quá trình phân li nước sẽ diễn ra chậm hơn, dẫn đến sự giảm nồng độ proton H+ trong dung dịch. Điều này sẽ làm chậm quá trình hình thành ion hydronium H3O+.
Ảnh hưởng của pH đến sự hình thành ion hydronium H3O+
pH của dung dịch cũng là một yếu tố ảnh hưởng đến sự hình thành ion hydronium H3O+. Cụ thể:
Môi trường axit
Trong môi trường axit, nồng độ proton H+ cao, điều này sẽ thúc đẩy quá trình hình thành ion hydronium H3O+.
Môi trường bazơ
Trong môi trường bazơ, nồng độ proton H+ thấp, do đó quá trình hình thành ion hydronium H3O+ sẽ bị hạn chế.
Môi trường trung tính
Trong môi trường trung tính, nồng độ proton H+ vừa phải, quá trình hình thành ion hydronium H3O+ sẽ diễn ra ở mức độ vừa phải.
Cơ chế tạo thành ion hydronium H3O+ trong dung dịch
Cơ chế tạo thành ion hydronium H3O+ trong dung dịch bao gồm các bước sau:
Bước 1: Sự phân li nước
Trong dung dịch, nước sẽ tự phân li một phần tạo ra proton H+ và ion hydroxide OH-:
H2O ⇌ H+ + OH-
Bước 2: Tương tác giữa proton H+ và nước
Proton H+ sẽ tương tác với phân tử nước H2O, hình thành trung gian phản ứng:
H+ + H2O ⇌ H3O+
Bước 3: Sự ổn định của ion hydronium H3O+
Ion hydronium H3O+ tương đối ổn định trong dung dịch, không dễ bị phân hủy hoặc tham gia các phản ứng hóa học khác.
Ứng dụng của ion hydronium H3O+ trong hóa học
Ion hydronium H3O+ có nhiều ứng dụng quan trọng trong hóa học, bao gồm:
Xác định pH
Nồng độ ion hydronium H3O+ trong dung dịch quyết định giá trị pH của dung dịch đó.
Phân tích axit-bazơ
Ion hydronium H3O+ là chất chỉ thị quan trọng trong các phản ứng axit-bazơ.
Xúc tác hóa học
Ion hydronium H3O+ có thể hoạt động như một chất xúc tác trong nhiều phản ứng hóa học.
Ứng dụng trong y học
Ion hydronium H3O+ có vai trò quan trọng trong các quá trình sinh học và y học.
Sự khác biệt giữa ion hydronium H3O+ và proton H+
Mặc dù ion hydronium H3O+ và proton H+ đều là các chất axit, nhưng chúng có một số khác biệt sau:
Cấu trúc
Ion hydronium H3O+ có cấu trúc phức tạp hơn, gồm ba nguyên tử hydro liên kết với một nguyên tử oxy. Proton H+ chỉ là một hạt tích điện dương đơn.
Tính chất
Ion hydronium H3O+ có tính lưỡng cực và bền vững hơn so với proton H+.
Ứng dụng
Ion hydronium H3O+ có nhiều ứng dụng hơn trong hóa học, y học và công nghiệp so với proton H+.
Mối quan hệ giữa ion hydronium H3O+ và ion hydroxide OH-
Ion hydronium H3O+ và ion hydroxide OH- có mối quan hệ rất mật thiết, thể hiện ở các điểm sau:
Cân bằng axit-bazơ
Sự hiện diện của ion hydronium H3O+ và ion hydroxide OH- trong dung dịch tạo nên cân bằng axit-bazơ.
Phản ứng trung hòa
Ion hydronium H3O+ và ion hydroxide OH- có thể phản ứng với nhau để tạo thành nước:
H3O+ + OH- → 2H2O
Ảnh hưởng đến pH
Nồng độ tương đối của ion hydronium H3O+ và ion hydroxide OH- quyết định giá trị pH của dung dịch.
Sự phân li ion hydronium H3O+ trong môi trường nước
Trong môi trường nước, ion hydronium H3O+ có thể bị phân li một phần, theo phương trình:
H3O+ ⇌ H+ + H2O
Quá trình này diễn ra với hằng số cân bằng Kw, thể hiện mối quan hệ giữa nồng độ H+ và OH- trong dung dịch.
Kết luận
Ion hydronium H3O+ là một loại ion rất quan trọng trong hóa học, với nhiều tính chất và ứng dụng đa dạng. Sự hình thành ion hydronium từ H2O và H+ diễn ra thông qua các quá trình phức tạp, chịu ảnh hưởng của nhiệt độ và pH. Hiểu rõ về ion hydronium sẽ giúp chúng ta nắm vững các khái niệm cơ bản về axit-bazơ, pH và các ứng dụng hóa học liên quan.
H3O+ tương đối bền vững trong dung dịch, không dễ bị phân hủy hoặc tham gia các phản ứng hóa học khác.
Ảnh hưởng đến pH
Sự hiện diện của ion hydronium H3O+ trong dung dịch sẽ làm giảm pH của dung dịch, tạo ra môi trường axit.
Ảnh hưởng của nhiệt độ đến sự hình thành ion hydronium H3O+
Nhiệt độ là một yếu tố ảnh hưởng đến sự hình thành ion hydronium H3O+ trong dung dịch. Cụ thể:
Tăng nhiệt độ
Khi nhiệt độ tăng, quá trình phân li nước sẽ diễn ra mạnh hơn, dẫn đến sự gia tăng nồng độ proton H+ trong dung dịch. Điều này sẽ thúc đẩy quá trình hình thành ion hydronium H3O+.
Giảm nhiệt độ
Khi nhiệt độ giảm, quá trình phân li nước sẽ diễn ra chậm hơn, dẫn đến sự giảm nồng độ proton H+ trong dung dịch. Điều này sẽ làm chậm quá trình hình thành ion hydronium H3O+.
Ảnh hưởng của pH đến sự hình thành ion hydronium H3O+
pH của dung dịch cũng là một yếu tố ảnh hưởng đến sự hình thành ion hydronium H3O+. Cụ thể:
Môi trường axit
Trong môi trường axit, nồng độ proton H+ cao, điều này sẽ thúc đẩy quá trình hình thành ion hydronium H3O+.
Môi trường bazơ
Trong môi trường bazơ, nồng độ proton H+ thấp, do đó quá trình hình thành ion hydronium H3O+ sẽ bị hạn chế.
Môi trường trung tính
Trong môi trường trung tính, nồng độ proton H+ vừa phải, quá trình hình thành ion hydronium H3O+ sẽ diễn ra ở mức độ vừa phải.
Cơ chế tạo thành ion hydronium H3O+ trong dung dịch
Cơ chế tạo thành ion hydronium H3O+ trong dung dịch bao gồm các bước sau:
Bước 1: Sự phân li nước
Trong dung dịch, nước sẽ tự phân li một phần tạo ra proton H+ và ion hydroxide OH-:
H2O ⇌ H+ + OH-
Bước 2: Tương tác giữa proton H+ và nước
Proton H+ sẽ tương tác với phân tử nước H2O, hình thành trung gian phản ứng:
H+ + H2O ⇌ H3O+
Bước 3: Sự ổn định của ion hydronium H3O+
Ion hydronium H3O+ tương đối ổn định trong dung dịch, không dễ bị phân hủy hoặc tham gia các phản ứng hóa học khác.
Ứng dụng của ion hydronium H3O+ trong hóa học
Ion hydronium H3O+ có nhiều ứng dụng quan trọng trong hóa học, bao gồm:
Xác định pH
Nồng độ ion hydronium H3O+ trong dung dịch quyết định giá trị pH của dung dịch đó.
Phân tích axit-bazơ
Ion hydronium H3O+ là chất chỉ thị quan trọng trong các phản ứng axit-bazơ.
Xúc tác hóa học
Ion hydronium H3O+ có thể hoạt động như một chất xúc tác trong nhiều phản ứng hóa học.
Ứng dụng trong y học
Ion hydronium H3O+ có vai trò quan trọng trong các quá trình sinh học và y học.
Sự khác biệt giữa ion hydronium H3O+ và proton H+
Mặc dù ion hydronium H3O+ và proton H+ đều là các chất axit, nhưng chúng có một số khác biệt sau:
Cấu trúc
Ion hydronium H3O+ có cấu trúc phức tạp hơn, gồm ba nguyên tử hydro liên kết với một nguyên tử oxy. Proton H+ chỉ là một hạt tích điện dương đơn.
Tính chất
Ion hydronium H3O+ có tính lưỡng cực và bền vững hơn so với proton H+.
Ứng dụng
Ion hydronium H3O+ có nhiều ứng dụng hơn trong hóa học, y học và công nghiệp so với proton H+.
Mối quan hệ giữa ion hydronium H3O+ và ion hydroxide OH-
Ion hydronium H3O+ và ion hydroxide OH- có mối quan hệ rất mật thiết, thể hiện ở các điểm sau:
Cân bằng axit-bazơ
Sự hiện diện của ion hydronium H3O+ và ion hydroxide OH- trong dung dịch tạo nên cân bằng axit-bazơ.
Phản ứng trung hòa
Ion hydronium H3O+ và ion hydroxide OH- có thể phản ứng với nhau để tạo thành nước:
H3O+ + OH- → 2H2O
Ảnh hưởng đến pH
Nồng độ tương đối của ion hydronium H3O+ và ion hydroxide OH- quyết định giá trị pH của dung dịch.
Sự phân li ion hydronium H3O+ trong môi trường nước
Trong môi trường nước, ion hydronium H3O+ có thể bị phân li một phần, theo phương trình:
H3O+ ⇌ H+ + H2O
Quá trình này diễn ra với hằng số cân bằng Kw, thể hiện mối quan hệ giữa nồng độ H+ và OH- trong dung dịch.